翁丹丹,陈龙达,徐勋,黄冠成
目前慢性乙型病毒性肝炎(CHB)抗病毒药物主要有核苷(酸)类药物(NAs)和干扰素(IFN)[1],NAs具有良好的耐受性,给药方式(口服)方便快捷,是目前国内外大部分乙型肝炎病毒(HBV)感染患者首选的抗病毒方案[2]。然而NAs治疗也存在一定的弊端,绝大多数患者需要长期服药、血清学应答/转换率较低,部分患者仍有肝细胞肝癌(HCC)发生[3]。聚乙二醇干扰素(Peg-IFN)是通过抗病毒及加强宿主免疫反应达到其治疗CHB的作用[4],然而对于乙型肝炎E抗原(HBeAg)阳性/阴性的CHB初治患者使用Peg-IFN治疗仅8%能实现乙型肝炎表面抗原(HBsAg)清除[5]。无论是Peg-IFN,还是NAs均无法彻底清除HBV,达到真正意义上的治愈[6]。因此,通过合理组合使用现有的抗病毒药物,实现HBV感染的“功能性治愈”是现阶段可及的更高治疗目标[7]。本研究将已使用恩替卡韦(ETV)或富马酸替诺福韦二吡呋酯(TDF)治疗的HBV感染者和非活动性HBsAg携带者作为研究对象,对其行ETV/TDF联合Peg-IFN-或Peg-IFN-单药治疗,旨在探讨其疗效及安全性。报道如下。
1.1 一般资料 收集2019年1月至2021年12月浙江省余姚市人民医院收治的HBV感染患者250例,其中男129例,女121例;
年龄18~60岁,平均(43.4±9.0)岁;
HBsAg水平0.5~487.19 IU/ml,平均(247.88±40.15)IU/ml。纳入标准:(1)符合《中国慢性乙型肝炎防治指南》中[8]HBV感染的诊断标准;
(2)意识清晰,沟通良好,能够较好配合临床用药治疗和完成相关检查,治疗依从性良好;
(3)临床资料完整。排除标准:(1)有IFN治疗禁忌证或过敏者;
(2)合并有甲型、丙型、丁型、戊型肝炎,肝硬化,酒精性肝病,自身免疫性肝病,代谢性肝病等除CHB外的其他类型肝病者;
(3)HIV感染,恶性肿瘤,严重心、肺、肾功能障碍者;
(4)未控制的糖尿病及甲状腺疾病者;
(5)处于妊娠期、哺乳期及合并精神疾病者。治疗期间发生如下临床事件时提前终止:(1)肝功能衰竭;
(2)肝硬化程度加重或恶化,肝硬化失代偿;
(3)严重药物不良反应;
(4)死亡。本研究经余姚市人民医院医学伦理委员会审核批准,符合赫尔辛基宣言的规定,所有治疗措施和样本收集均在患者知情同意下进行。
1.2 分组 250例患者中,50例为非活动性HBsAg携带者,仅采用Peg-IFN-治疗(Peg-IFN-单药治疗组),而有5例因药物不良反应无法耐受而停止治疗,予以剔除,最终入组45例,HBsAg水平为(247.63±38.15)IU/mL。Peg-IFN-单药治疗组除满足上述纳入和排除标准外,还同时满足:HbsAg≤500 IU/ml,血清HBV DNA定量<100 IU/ml。
余200例患者按照治疗方案的不同分为ETV联合Peg-IFN-治疗组、TDF联合Peg-IFN-治疗组、ETV单药治疗组及TDF单药治疗组,各50例。因无法耐受药物不良反应或者自行停药中途停止治疗,ETV联合Peg-IFN-治疗组、TDF联合Peg-IFN-治疗组、ETV单药治疗组及TDF单药治疗组分别退出3例、4例、2例及2例,最终分别入组47例、46例、48例及48例,HBsAg水平分别为(248.26±38.49)IU/ml、(249.03±38.55)IU/ml、(246.13±39.06)IU/ml 及(245.77±37.03)IU/ml。上述4组患者还同时满足:正在接受ETV或TDF治疗达1年以上,HBsAg≤500 IU/ml,血清HBV DNA定量<100 IU/ml,HBeAg阳性或阴性。
1.3 治疗方法 Peg-IFN-单药治疗组:经腹部皮下注射Peg-IFN-注射液(厦门特宝生物工程股份有限公司,国药准字:S20160001,规格180g:0.5 ml)180g/次,1次/周,持续治疗48周。ETV单药治疗组:口服ETV(中美上海施贵宝制药有限公司,国药准字:H20052237,规格:0.5 mg/片),0.5 mg/次,1次/d,治疗时间为48周。TDF单药治疗组:口服TDF(天津葛兰素史克有限公司,国药准字:H20080319,规格:300 mg/片),300 mg/次,1次/d,治疗时间为48周。ETV联合Peg-IFN-治疗组及TDF联合Peg-IFN-治疗组在原有ETV或TDF治疗的基础上,联合Peg-IFN-进行治疗(方法同Peg-IFN-单药治疗组)。
1.4 观察指标(1)血常规指标。治疗12、24、36及48周比较5组白细胞计数(WBC)、粒细胞计数(NEUT)、血红蛋白(HBG)及血小板计数(PLT)水平。(2)肝功能指标。治疗12、24、36及48周采用Olympus AU2700全自动生化分析仪检测5组丙氨酸氨基转移酶(ALT)及天门冬氨酸氨基转移酶(AST)水平。(3)HBsAg检测。初始治疗,治疗12、24、36及48周检测5组外周血HBsAg水平,采用美国雅培Abbott AxSYM System全自动化学发光酶免分析仪或罗氏公司的自动电化学发光定量免疫分析法。比较5组不同时间点的HBsAg水平,HBsAg清除率及HBsAg血清转换率,其中HBsAg<0.05 IU/ml为HBsAg清除,抗-HBs>10 IU/mL视为HBsAg血清学转换。(4)观察5组治疗期间的不良反应发生情况,包括发热、头痛、乏力、恶心呕吐、脱发、粒细胞减少及骨髓抑制等。(5)治疗后48周按照是否达到“功能性治愈”标准将患者分为功能性治愈组和非功能性治愈组,分析功能性治愈的影响因素。功能性治愈:有限疗程的抗病毒治疗后获得持续的HBsAg以及HBV DNA清除,伴或不伴抗HBsAg血清学转换,肝脏损伤得到改善以及后续发生HCC的风险降低。
1.5 统计方法 数据采用SPSS 17.0软件处理,计量资料采用均数±标准差表示,多组间比较采用F检验,多重比较采用LSD-t检验;
计数资料采用2检验。影响因素分析采用多因素Logistic回归分析。P<0.05表示差异有统计学意义。
2.1 血常规指标变化 ETV联合Peg-IFN-治疗组与ETV单药治疗组,TDF联合Peg-IFN-治疗组与TDF单药治疗组治疗12、24、36及48周的WBC及PLT水平差异均有统计学意义(t≥2.69,均P<0.05)。ETV联合Peg-IFN-治疗组与ETV单药治疗组,TDF联合Peg-IFN-治疗组与TDF单药治疗组在治疗36及48周NEUT水平差异均有统计学意义(t≥9.31,均P<0.05),见表1。

表1 5组治疗期间不同时间点的血常规指标变化
2.2 肝功能水平变化 ETV联合Peg-IFN-治疗组及TDF联合Peg-IFN-治疗组在治疗12、24、36及48周ALT及AST水平均高于ETV单药治疗组与TDF单药治疗组,差异均有统计学意义(t≥4.50,均P<0.05)。ETV联合Peg-IFN-治疗组、TDF联合Peg-IFN-治疗组与Peg-IFN-单药治疗组各时间点ALT及AST水平差异均无统计学意义(t≤0.58,均P>0.05),见表2。

表2 5组治疗不同时间点的肝功能水平变化 U/L
2.3 HBsAg水平变化 ETV联合Peg-IFN-治疗组与ETV单药治疗组,TDF联合Peg-IFN-治疗组与TDF单药治疗组,ETV联合Peg-IFN-治疗组与Peg-IFN-单药治疗组,TDF联合Peg-IFN-治疗组与Peg-IFN-单药治疗组不同时间点的HBsAg水平差异均有统计学意义(t≥3.84,均P<0.05)。TDF联合Peg-IFN-治疗组在治疗12、24、36及48周的HBsAg水平均明显低于同期ETV联合Peg-IFN-治疗组(t≥3.46,均P<0.05),见表3。
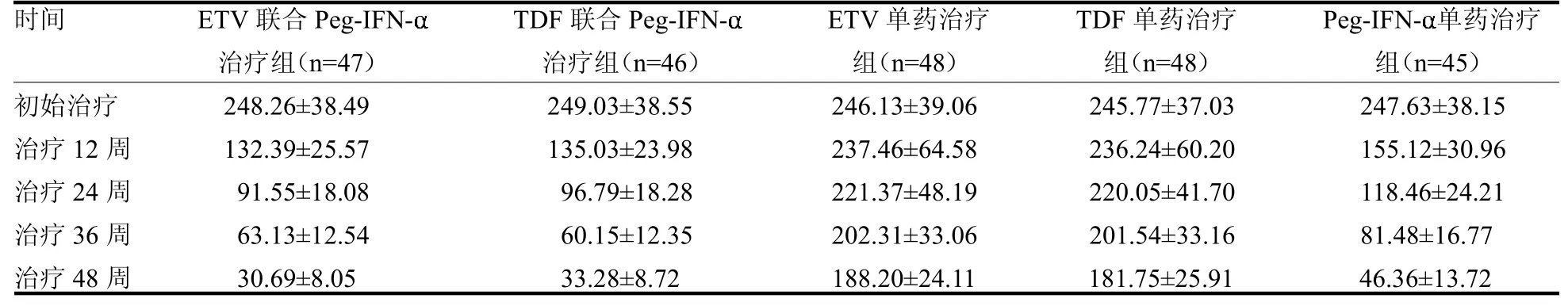
表3 5组治疗期间的HBsAg水平变化 IU/ml
2.4 HBV转归情况 TDF联合Peg-IFN-治疗治疗组、ETV联合Peg-IFN-治疗组在48周HBsAg清除率、HBsAg血清转换率明显高于ETV单药治疗组、TDF单药治疗组及Peg-IFN-单药治疗组(2≥8.25,均P<0.05)。TDF联合Peg-IFN-治疗组在48周HBsAg清除率、HBsAg血清转换率稍高于ETV联合Peg-IFN-治疗组,差异均无统计学意义(2≤0.26,均P>0.05),见表4。

表4 5组治疗期间的HBV转归情况比较 例(%)
2.5 不良反应发生情况 ETV联合Peg-IFN-治疗组各项不良反应发生率均明显高于ETV单药治疗组,TDF联合Peg-IFN-治疗组中各项不良反应的发生率均明显高于TDF单药治疗组(2≥4.26,均P<0.05),见表5。

表5 5组治疗期间的不良反应发生率比较 例(%)
2.6 影响功能性治愈的因素分析 结果显示,年龄、性别、联合治疗,初始治疗及12周时的HBsAg水平均是功能性治愈的影响因素(均P<0.05),见表6。

表6 影响功能性治愈的多因素Logistic回归分析
通过合理组合使用现有的抗病毒药物,实现HBV感染的“功能性治愈”是现阶段可及的更高治疗目标。据报道,相对于HBsAg和HBeAg双阳性患者,HBeAg清除可使HCC发生率降低6倍[9-10],HBeAg和HBsAg清除(功能性治愈)可使HCC的发生率降低60倍[11]。因此,慢性HBV感染疾病不但需要积极抗病毒治疗,而且选择低水平HBsAg感染者或NAs经治患者达到合适时机时,通过优化治疗,追求功能性治愈,以减少HCC发生的风险,显得意义重大。
本研究结果显示,ETV联合Peg-IFN-治疗组与ETV单药治疗组,TDF联合Peg-IFN-治疗组与TDF单药治疗组治疗12、24、36及48周的WBC及PLT水平差异均有统计学意义(均P<0.05);
ETV联合Peg-IFN-治疗组各项不良反应发生率均明显高于ETV单药治疗组,TDF联合Peg-IFN-治疗组中各项不良反应的发生率均明显高于TDF单药治疗组(均P<0.05)。Peg-IFN-治疗可导致WBC及PLT水平下降明显,在一定程度上增加了相关不良反应的发生,但在治疗期间发现,多数患者可耐受治疗。此外,两联合治疗组在治疗12、24、36及48周的ALT及AST水平均分别明显高于口服单药治疗组,说明在NAs治疗的基础上联合Peg-IFN-治疗,ALT、AST水平会在治疗前期出现明显的反应性升高。联合用药组(ETV联合Peg-IFN-治疗组、TDF联合Peg-IFN-治疗组)在治疗不同时间点的HBsAg水平均明显低于单一用药组(ETV单药治疗组、TDF单药治疗组、Peg-IFN-治疗组),联合用药组和单一用药组在部分时间点的HBsAg清除率、HBsAg血清转换率上存在明显差异,上述结果说明NAs联合IFN较单一用药的治疗效果更佳。本研究结果显示,年龄、性别、联合治疗,初始治疗及治疗12周时的HBsAg水平均是功能性治愈的影响因素。
综上所述,NAs联合IFN方案在治疗HBsAg低水平患者上疗效显著,效果优于ETV、TDF、Peg-IFN-单药治疗,其中TDF联合Peg-IFN-和ETV联合Peg-IFN-两组联合用药方案中,TDF联合Peg-IFN-在降低HBsAg上更具优势。
利益冲突 所有作者声明无利益冲突
猜你喜欢转换率单药抗病毒慢性乙型肝炎抗病毒治疗是关键肝博士(2022年3期)2022-06-30浅谈SCR反应器模型计算与分析中国设备工程(2021年13期)2021-07-15抗病毒治疗可有效降低HCC的发生及改善患者预后肝博士(2021年1期)2021-03-29恩替卡韦在阿德福韦单药治疗患者中的应用肝博士(2021年1期)2021-03-29恩替卡韦在阿德福韦酯单药治疗患者中的应用肝博士(2020年5期)2021-01-18四川盆地海相碳酸盐岩天然气资源量储量转换规律天然气勘探与开发(2020年4期)2021-01-11抗病毒药今天忘吃了,明天要多吃一片吗?肝博士(2020年4期)2020-09-24对抗病毒之歌疯狂英语·初中天地(2020年3期)2020-05-21太阳能硅片表面损伤层与转换率的研究山东工业技术(2018年2期)2018-03-20唑来膦酸单药治疗肺癌骨转移患者的疗效及不良反应中国继续医学教育(2015年1期)2016-01-06