刘倩峰 杨佩璇 庞超 李庆星 周金阔
(河北医科大学第一医院 1口腔科,河北 石家庄 050031;
2病理科)
口腔鳞状细胞癌(OSCC)是头颈部最常见的恶性肿瘤。手术是OSCC患者的一线治疗方法。然而,外科治疗使患者出现严重的口腔功能障碍,导致吞咽困难和构音困难〔1〕。因此,OSCC探索早期诊断和治疗方法成为近年来研究的重要方向。研究发现,一些肿瘤基因和抑癌基因可能在促进或启动OSCC的发展中起着关键作用〔2〕。因此,阐明基因组和表观基因组参与多步骤癌变和OSCC进展的机制具有重要意义。MicroRNA-7-5P(miR-7-5p) 由具有发夹结构的单链前体RNA-7-5P经过Dicer酶加工后生成〔3〕,其在OSCC中的研究较少,研究表明miR-7在癌细胞中会发生启动子甲基化〔4〕。也有研究提出miR-7的异常表达参与了舌鳞状细胞癌的增殖和凋亡〔5〕。但这些研究证据尚不充足,尤其是miR-7-5p在OSCC中的作用,有待进一步探究。
周期素依赖性激酶(CDK)-10,是细胞分裂周期蛋白(Cdc)2激酶家族的一员,在细胞周期从G2期向M期发展过程中起重要作用〔6〕。研究发现CDK-10在多种肿瘤组织中的表达升高,提示CDK-10是一种抑癌基因〔7〕,然而,CDK-10在OSCC中表达模式及miR-7-5p对CDK-10调控作用尚不清楚。本研究重点探索miR-7-5p在OSCC中的表达及其调控CDK-10对细胞增殖、凋亡与周期影响。
1.1临床标本 收集河北医科大学第一医院病理科68例OSCC患者的OSCC样本组织和匹配的邻近组织(距肿瘤边缘至少2 cm)。OSCC患者术前均未接受放疗或化疗。另收集临床健康志愿者50例,获取OSCC患者术前及健康志愿者的空腹血清样本。样本均由病理学专家验证,立即在液氮中冷冻。本研究获得医院伦理审查委员会批准,所有患者知情同意。
1.2血清miR-7-5p和CDK-10蛋白表达检测 采用RT-qPCR分析血清miR-7-5p表达,酶联免疫吸附试验(ELISA)分析血清CDK-10蛋白表达。RNA分离与RT-qPCR分析,用QIAzol试剂(德国Duesseldorf,Qiagen)提取总RNA,用cDNA逆转录试剂盒(文氏酵母,Waltham,MA)合成cDNA。按商品说明书,使用SYBR-绿色PCR试剂盒(Invitrogen,Carlsbad,CA)进行RT-qPCR。U6 snRNA用于miR-7-5p的正常对照,GAPDH用于OXR1 mRNA的正常对照。ELISA检测CDK-10蛋白参照试剂盒说明书进行。
1.3细胞系与细胞培养 OSCC细胞株SCC-25细胞在含10%胎牛血清(FBS)的DMEM中培养。收集对数期细胞,接种于6孔板(1×10/孔)中。当细胞达到80%汇合时,按照制造商的程序,使用脂质体2000(Invitrogen)将miR-7-5p-模拟物(mimics)(100 nmol/L)、miR-7-5p-抑制剂(inhibitor,100 nmol/L)和空白质粒(100 nmol/L)转染细胞,分别作为miR-7-5p过表达组、miR-7-5p抑制组、空白对照组,转染48 h后取细胞。
1.4Western印迹分析 用细胞裂解试剂(Sigma-Aldrich,St.Louis,MO)裂解细胞,提取总蛋白。蛋白质浓度用Bradford法测定。用10%十二烷基硫酸钠-聚丙烯酰胺凝胶分离蛋白质,并将其电转移到聚偏氟乙烯(PVDF)膜(GE Healthcare,Little Chalfont,Buckinghamshire,UK)上,在5%脱脂牛奶中室温孵育1.5 h。含半胱氨酸的天冬氨酸蛋白水解酶(Caspase)3/8/9抗体,CDK-10抗体、B淋巴细胞瘤-2基因(Bcl-2)相关X蛋白(Bax)抗体、Bcl-2抗体和GAPDH(Sigma-Aldrich,目录号:SAB2701826)在1∶1 000稀释,然后在4℃下与膜一起孵育过夜。第2天将辣根过氧化物酶(HPR)-结合的二级抗体添加到膜中并孵育1 h。使用融合SL成像系统(Viber Lourmat,法国)显色,以GAPDH为内对照。胶片拍照,用凝胶图像处理系统分析目标带的光密度(OD)值。
1.5双荧光素酶报告分析 miR-7-5p和CDK-10的结合位点使用网站http://www.Target Scan.org预测,利用PmiRGLO双荧光素酶miRNA靶向表达载体(E1330;
Promega,Madison,WI)构建miR-7-5p-CDK-10报告基因。分为空白对照组(转染miR-7-5p NC)和miR-7-5p过表达组(转染miR-7-5p mimics),用Lipidosome2000(Invitrogen)共转染HEK293T细胞用双荧光素酶报告系统(Promega)测定荧光素酶活性。
1.6MTT法和乳酸脱氢酶(LDH)活性检测 细胞转染48 h后,收集的细胞种在96孔板(2×10个/孔)。向每个孔中加入20 μl 5 g/L MTT溶液(Sigma,Saint Louis,MO),孵育4 h,然后加入150 μl二甲基亚砜(DMSO),再孵育15 min。在570 nm波长处测量光吸收率。细胞转染48 h后,收集的细胞种在96孔板(2×10个/孔)。根据试剂和说明书,检测LDH活性,在450 nm波长处测量光吸收率。
1.7免疫组化 取OSCC组织切片和癌旁组织切片进行常规二甲苯脱蜡,经各级浓度乙醇水化。取一定量pH6.0柠檬酸盐缓冲液(北京中杉金桥生物技术有限公司),加入微波盒中,医用微波炉中火加热切片3 min×2次进行抗原修复,凉至室温40 min。每张切片加1滴3%过氧化氢(H2O2),室温下孵育10 min。加1滴稀释倍数为1∶100的第一抗体(抗CDK-10突变单克隆兔抗体,美国Cell Signaling Technology公司),4℃冰箱过夜。而后加HPR标记的第二抗体(北京中杉金桥生物技术有限公司),37℃温箱30~40 min。每张切片加1滴新鲜配制的二氨基联苯胺(DAB)液显色20 min,用淡苏木素复染细胞核30 s,各级浓度乙醇快速脱水,二甲苯透明,中性树脂封片,晾干后观察。
1.8统计学方法 采用SPSS21.0软件进行t检验、χ2检验、Spearman相关性分析。
2.1miR-7-5p和CDK-10在OSCC患者中的表达量 与正常志愿者血清比较,OSCC患者血清中miR-7-5p表达量显著下降,CDK-10表达量显著升高(P<0.05)。见表1。CDK-10在OSCC组织中细胞阳性率〔83.8%(57/68)〕明显高于癌旁组织〔8.8%(6/68)〕。见图1。OSCC患者血清中miR-7-5p与CDK-10呈负相关(r=-0.682,P<0.05)。见图2。

表1 miR-7-5p和CDK-10表达

图1 免疫组化法检测OSCC组织和癌旁组织中CDK-10 表达(HE染色,阳性细胞为黄褐色或褐色,×200)

图2 OSCC患者中miR-7-5p与CDK-10呈负相关
2.2miR-7-5p调控OSCC细胞中CDK-10表达量 miR-7-5p与CDK10结合位点见图3。荧光素酶报告基因实验结果显示,与空白对照组(1.02±0.08)相比,miR-7-5p与野生型CDK10 3′UTR共转染后,检测到荧光素酶活性显著降低(0.35±0.13,P<0.01)。而与突变型CDK10 3′UTR共转染后,荧光素酶活性无明显变化(1.00±0.00 vs 0.91±0.06,P>0.05)。体外细胞实验显示,与空白对照组比较,miR-7-5p过表达组miR-7-5p显著升高,CDK-10显著降低(P<0.05)。与miR-7-5p抑制组比较,miR-7-5p过表达组miR-7-5p显著升高,CDK-10显著降低(P<0.05)。见表2。
2.3miR-7-5p调控OSCC细胞周期 与miR-7-5p抑制组比较,miR-7-5p过表达组S期、G2M期显著升高,G0/G1期显著降低(P<0.05)。见表3。
2.4miR-7-5p调控OSCC细胞caspase-3、caspase-8、caspase-9、Bax、Bcl-2和CDK-10的活性水平 与miR-7-5p抑制组和空白对照组比较,miR-7-5p过表达组caspase-3、8、9及Bax水平显著升高,Bcl-2、CDK-10显著降低(P<0.05)。见图4、表4。

图3 miR-7-5p与CDK-10结合位点

表2 miR-7-5p调控OSCC细胞中 CDK-10表达量
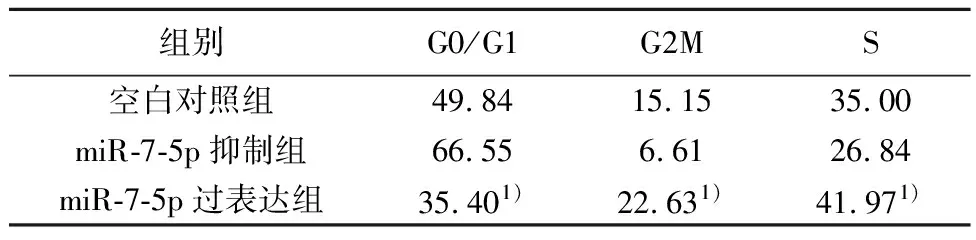
表3 miR-7-5p和CDK-10调控口腔鳞癌细胞 细胞周期(%,n=3)

1~3:空白对照组、miR-7-5p抑制组、miR-7-5p过表达组图4 Western印迹检测各组OSCC细胞蛋白表达

表4 miR-7-5p调控OSCC细胞caspase-3、caspase-8、caspase-9、Bax、Bcl-2和CDK-10的活性水平和光密度值
2.5MTT法和LDH活性检测miR-7-5p调控OSCC细胞 与miR-7-5p抑制组和空白对照组比较,miR-7-5p过表达组LDH水平显著升高,MTT显著降低,(P<0.05)。见表5。

表5 MTT法和LDH活性检测结果
OSCC是一种在世界范围内高度流行的癌症,转移和放化疗耐受是OSCC致死的主要原因〔8〕,研究表明,miR-7-5p异常表达可促进肿瘤发生发展,miR-7-5p是否发生启动子区域甲基化改变与侵袭性肿瘤的发生和发展有关〔9〕。CDK-10在体外和体内研究中对细胞凋亡和肿瘤发生发展密切相关,其甲基化同淋巴结转移和临床分期相关〔10〕。本研究结果显示,miR-7-5p与CDK-10结合发生结合,CDK-10是miR-7-5p口腔鳞癌重要的靶点。这与miR-7-5p在其他肿瘤中的表达趋势具有一致性;
miR-7-5p可能是OSCC患者重要的靶点,其机制可能与CDK-10具有相关性。
研究表明,miRNAs可以作为肿瘤筛查、诊断和预后的生物标志物〔11〕。有研究发现,miR-7-5P的稳定过表达会伴随着DNA甲基化和组蛋白修饰。miR-7-5p甲基化的发生也与患者治疗后的进展生存期和总体生存率有关〔12〕。也有研究表明,miR-7-5p在结直肠癌的肿瘤组织和细胞中也发生高度的甲基化,miR-7-5p可能是诊断结直肠癌的标志物〔13〕。本研究中,在OSCC患者血清中miR-7-5p表达量显著下降,说明miR-7-5p在OSCC的发生中起到重要作用。miR-7-5p主要通过影响细胞周期并促进干细胞分化来调节细胞增殖〔14〕,一项研究表明,miR-7-5p通过靶向Bcl-2调节人乳头状癌细胞的增殖和转移,miR-7通过靶向Bax和Sirt2抑制帕金森病模型中神经元细胞的凋亡〔15〕。也有研究发现,miR-7-5p抑制舌鳞状细胞的增殖,迁移和侵袭〔16〕。本研究结果表明,miR-7-5p可能通过CDK-10调控细胞周期调节细胞增殖与细胞凋亡;
miR-7-5p对CDK-10的调节作用,这和通过调节caspase-3及Bax/Bcl2等典型细胞凋亡因子促进细胞凋亡具有相似的作用,miR-7-5p可能是OSCC发生的重要潜在靶点。
CDK-10被证明能促进细胞增殖,具有抑癌作用〔17〕。有研究发现CDK-10在胆管肿瘤和细胞系中的表达均下调,CDK-10过表达或敲除分别抑制或促进细胞增殖、集落形成和迁移〔18〕。研究证实,基因启动子高频甲基化是造成恶性肿瘤中CDK-10表达下调的重要原因〔19〕,也有转录组学和蛋白质组学研究中发现,癌细胞或表现出加剧分裂的细胞中CDK-10的表达上调〔20〕。本研究发现miR-7-5p过表达可以减少OSCC细胞增殖和增加LDH水平,抑制miR-7-5p可以增加OSCC细胞增殖和减少LDH水平,这与miR-7-5p表达与caspase-3、8、9、Bax、Bcl-2、CDK-10之间的关系的结果具有一致性,说明,CDK-10可能是调控miR-7-5p促进OSCC细胞增殖和凋亡的重要靶点。
综上,OSCC患者血清中miR-7-5p表达量显著下降,CDK-10表达量显著升高,CDK-10可能是miR-7-5p调控OSCC细胞增殖、凋亡与周期的重要靶点。miR-7-5p有希望成为OSCC预后和诊断的评定指标。
但本研究也有一定不足,样本量较少,实验方案较为简单,统计可能存在较大误差,我们将在后续研究中继续改进和进一步探究。
猜你喜欢荧光素酶甲基化孵育NNMT基因启动子双荧光素酶报告系统的构建及其与SND1靶向关系的验证天津医科大学学报(2021年4期)2021-08-21不同双荧光素酶方法对检测胃癌相关miRNAs靶向基因TIAM1的影响中日友好医院学报(2021年1期)2021-04-14重组双荧光素酶报告基因质粒psiCHECK-2-Intron构建转染及转染细胞萤火虫荧光素酶和海肾荧光素酶表达山东医药(2020年9期)2020-05-20三物黄芩汤组分(群)配伍在大鼠肝微粒体孵育模型中的相互作用中成药(2017年9期)2017-12-19大鼠肝微粒体孵育体系中2种成分的测定及其代谢中成药(2017年5期)2017-06-13精子与慢病毒孵育制备转基因猪的分子检测及遗传分析华南农业大学学报(2015年5期)2015-12-04人多巴胺D2基因启动子区—350A/G多态位点荧光素酶表达载体的构建与鉴定及活性检测中国医药导报(2015年27期)2015-02-28鼻咽癌组织中SYK基因启动子区的甲基化分析现代检验医学杂志(2015年2期)2015-02-06胃癌DNA甲基化研究进展沈阳医学院学报(2014年4期)2014-12-27基因组DNA甲基化及组蛋白甲基化遗传(2014年3期)2014-02-28