刘芳贤 朱 俭 韦淙宝 唐嘉晨 邓西林
1 桂林医学院附属医院,广西桂林市 541001;
2 湖南省常德市第一人民医院
鼻咽癌是临床常见的恶性肿瘤,尤其在我国南方部分地区多发,对居民的健康产生了极大的威胁。近年来鼻咽癌的发病率逐年增长,约为1.65/10万~5/10万,死亡率也有所升高,目前累积死亡率约为0.14%,已引起该领域工作人员的高度重视[1]。大多鼻咽癌发病早期并无特异性临床表现,而中晚期可出现鼻塞、涕中带血、听力下降、耳闷堵感等表现,常错过最佳的治疗时机。研究指出[2],鼻咽癌的发生和发展受多种因素的影响,其中细胞生物学行为调控基因和蛋白的异常表达是重要的基础条件。单核细胞趋化蛋白-3(MCP-3)是一种重要的趋化因子,可活化和趋化免疫细胞,在恶性肿瘤免疫细胞浸润病理改变过程中具有重要的作用[3]。国内外研究发现[4-6],MCP-3可结合和活化多种趋化因子受体,从而调控细胞免疫,在大肠癌主动免疫、喉鳞癌发生和发展中均有一定作用,且与肿瘤内炎性微环境有关,从而可影响恶性肿瘤的发生与发展。但MCP-3在鼻咽癌组织中是否异常表达及其与临床特征是否有紧密关系仍尚未可知。为此,本文对82例鼻咽癌活检确诊的石蜡存档组织检测MCP-3 mRNA、蛋白表达,并分析其与临床特征的关系,以加深对鼻咽癌的认识。
1.1 临床资料 选取医院2017年6月—2019年6月收治82例鼻咽癌患者的临床资料进行回顾。(1)纳入标准:①均采用组织活检病理学检查证实为鼻咽癌;
②活检组织均石蜡包埋存档;
③均有完整的临床特征数据资料;
④均经本人或家属同意;
(2)排除标准:①复发性或转移性鼻咽部恶性肿瘤者;
②活检确诊前接受放化疗等抗肿瘤治疗者;
③存在其他类型与MCP-3基因、蛋白异常表达有关的疾病者。本组患者中男46例、女36例,年龄38~76岁,平均年龄(55.83±10.06)岁,临床表现:无明显特异性临床表现者22例、颈部淋巴结肿大48例、涕中带血36例、耳闷堵感伴听力下降32例;
临床分期:Ⅰ~Ⅱ期61例、Ⅲ~Ⅳ期21例;
病理类型:鳞状细胞癌未分化2例、鳞状细胞癌低分化80例。
1.2 方法 实时荧光聚合酶链反应(RT-PCR)检测MCP-3 mRNA表达:取癌组织、癌旁组织(距癌组织0.5cm)各1cm3。液氮冷冻研磨匀浆,加入1ml Trizol试剂,离心分离(14 000r/min,3cm,10min)。抽提RNA,逆转录为cDNA。配置PCR反应体系,其中MCP-3 上游引物:5’-CTGGCTCGATAGCTAGAGCTAGATCGAT-3’;
下游引物:5’-CGCGCTAGATCGATATAGCTATAAGCGATCGA-3’,长度18bp、20bp;
β-actin上游引物:5’-TCGATAGCTAGATAGGCTAGATCGATAGCAGAGCTAG-3’;
下游引物:5’-CTAGATAGAGAGAAGCGAAGCGTAAGCTAGATCGAA-3’,长度均为20bp。实施扩增反应:95℃(30s),35个循环:95℃(5s)、58℃(20s)、52℃(30s),最后60℃(5min)。采用配套软件计算MCP-3 mRNA的相对表达量,即2-△△Ct。
免疫组化法(SP)检测MCP-3蛋白表达:同法取癌组织、癌旁组织。切片、烤片、消化并经室温孵育10min,灭活后加入鼠抗人MCP-3单克隆抗体(一抗,放大倍数1 000),孵育(4℃、过夜)。磷酸盐缓冲液冲洗(3次×5min),加入兔抗鼠MCP-3多克隆抗体(二抗,以辣根过氧化物酶标记,放大倍数5 000),孵育(27℃、2h)。加入适量显色液,苏木素复返,盐酸返蓝,封固。光镜下观察阳性染色细胞(细胞浆或细胞膜呈淡黄色、棕黄色或棕褐色),采用由 CMOS(日本 OLYMPUS 公司)及专用软件(美国 Imaging 技术公司)组成的计算机图像处理系统分析 MCP-3蛋白的表达,设定阳性细胞百分数:<1%、≥1%且<10%、≥10%且<50%、≥50%且<75%、≥75%且<100%分别记为0分、1分、2分、3分、4分;
显色强度:阴性、弱阳性、阳性、强阳性分别记为0分、1分、2分、3分。计算二者乘积,分别将0~3分、4~6分、7~9分、10~12分者记为阴性、弱阳性、阳性、强阳性表达。
1.3 观察指标 (1)对比癌组织、癌旁组织MCP-3 mRNA表达;
(2)对比癌组织、癌旁组织MCP-3 蛋白表达;
(3)对比不同临床特征患者癌组织MCP-3 mRNA、蛋白表达。
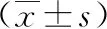
2.1 癌组织、癌旁组织MCP-3 mRNA表达对比 癌组织MCP-3 mRNA的相对表达量为1.02±0.20,高于癌旁组织的0.56±0.12(t=17.859,P=0.000<0.05)。
2.2 癌组织、癌旁组织MCP-3蛋白表达对比 癌组织、癌旁组织MCP-3蛋白表达分布对比差异显著(P<0.05),癌组织MCP-3蛋白阳性表达率高于癌旁组织(P<0.05),见表1、图1~2。

表1 癌组织、癌旁组织MCP-3蛋白表达对比[n(%)]

图1 鼻咽癌组织MCP-3染色阳性 图2 癌旁组织MCP-3染色阴性
2.3 不同临床特征患者癌组织MCP-3 mRNA、蛋白表达对比 不同性别、年龄、病理类型患者癌组织MCP-3 mRNA、蛋白表达对比差异均无统计学意义(P>0.05),Ⅲ~Ⅳ期患者癌组织MCP-3 mRNA相对表达量、蛋白阳性表达率均高于Ⅰ~Ⅱ期患者(P<0.05),见表2。
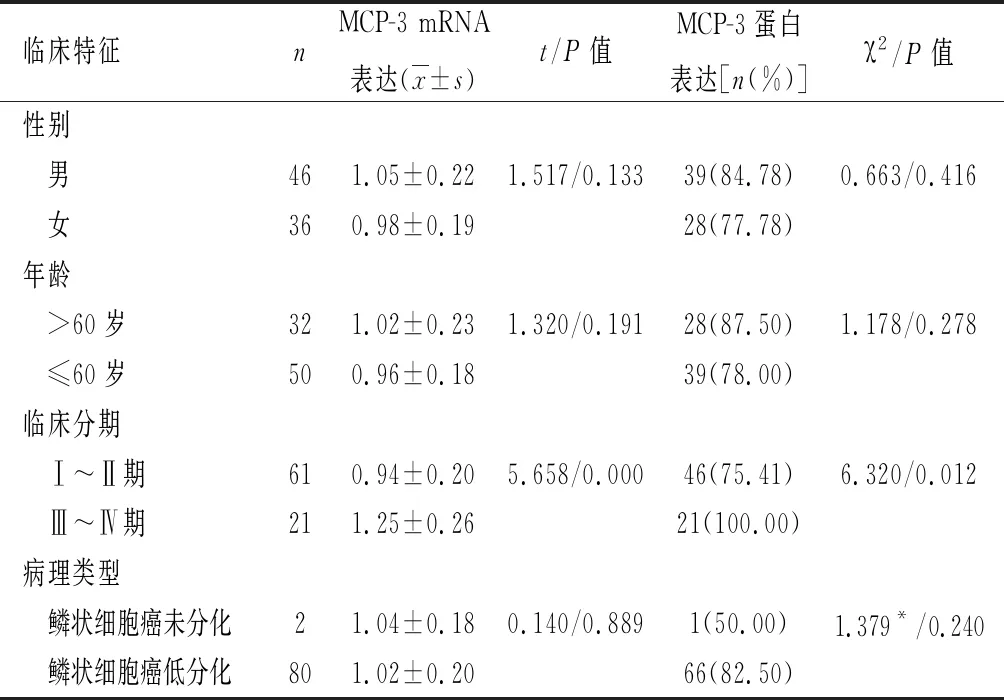
表2 不同临床特征患者癌组织MCP-3 mRNA、蛋白表达对比
鼻咽癌的发生与家族史、病毒感染、致癌物质接触等均有密切关联,但目前人们对该病发生与发展的机制认识尚浅。细胞增殖、凋亡、侵袭和转移等行为失控与多种基因和蛋白均有密切关联,是当前国内外研究的重点[7-9]。研究表明[10],鼻咽癌往往由于解剖位置隐蔽、特殊,与重要组织器官毗邻且容易侵犯周围组织,淋巴结转移的发生率高,预后差。除鼻咽癌细胞癌基因的激活和抑癌基因的失活参与病变外,免疫微环境紊乱也是疾病发生与发展的重要条件,可导致恶性肿瘤细胞免疫逃逸,为其异常增殖创造条件。而深入探讨与免疫微环境紊乱有关的调控机制对加深鼻咽癌的认识、研究新的治疗方案均具有至关重要的意义。
趋化因子是恶性肿瘤细胞发生、发展过程中的重要因子,与其免疫逃逸、增殖、迁移和侵袭等均密切相关,因此推测趋化因子的异常表达与鼻咽癌也有紧密关联。本次研究中,癌组织MCP-3 mRNA的相对表达量、蛋白阳性表达率均高于癌旁组织,且癌组织与癌旁组织MCP-3蛋白表达分布对比差异显著(P<0.05),可知在鼻咽癌组织中MCP-3基因与蛋白均高表达。MCP-3是一类重要的趋化因子,不仅可促进循环成血管细胞归巢,还可刺激其迁移,加快体内血管形成,而新血管的生成是鼻咽癌发生的重要条件[11]。有研究表明[12],采用MCP-3基因转染技术可提高肺癌干细胞的增殖、迁移、侵袭和成管能力,推测其高表达可能参与肺癌的发生和发展。MCP-3能够激活大量淋巴细胞,且对中性粒细胞也有趋化作用,可增加肿瘤周围组织内的树突细胞数量,提高嗜酸性粒细胞、T淋巴细胞、中性粒细胞的含量,参与炎性微环境的形成和维持。有研究推测恶性肿瘤组织的炎性微环境中MCP-3含量显著升高,可能参与淋巴细胞的招募与定位,是恶性肿瘤形成的必经过程,还可参与巨噬细胞转化为肿瘤相关巨噬细胞的病变过程[13]。结合上述分析和本研究结果可知在鼻咽癌组织中MCP-3基因与蛋白均高表达,推测可参与该病的发生和发展。
MCP-3激活不仅可加快新血管的生成,还可导致肿瘤微环境紊乱,使得大量促炎症因子分泌,共同参与恶性肿瘤的发生和发展。本文中显示,Ⅲ~Ⅳ期患者癌组织MCP-3 mRNA相对表达量、蛋白阳性表达率均高于Ⅰ~Ⅱ期患者,可知晚期鼻咽癌患者癌组织MCP-3 mRNA及蛋白表达均显著高于早中期患者,MCP-3异常高表达很可能与鼻咽癌患者的临床分期有相关性。MCP-3表达上调,可增加其效应细胞分泌的因子,参与肿瘤细胞的增殖、侵袭和转移,从而推动鼻咽癌患者的病情发展[14]。既往研究显示[15],在喉癌组织中MCP-3表达水平较高,且临床分期越高其表达水平越高,推测MCP-3的激活可参与喉癌的发生和发展。另有报道证实[16],在有淋巴结转移、肿瘤远处转移的患者癌组织中MCP-3基因与蛋白的表达水平更高,与本研究结果相符,证实MCP-3激活很可能与鼻咽癌的临床分期呈相关性。
综上所述,在鼻咽癌组织中MCP-3 mRNA及蛋白表达明显高于癌旁组织,且临床分期Ⅲ~Ⅳ期患者癌组织中MCP-3 mRNA及蛋白表达水平均更高,推测MCP-3的激活是鼻咽癌发生和发展的重要条件,在肿瘤靶向治疗方向显示出良好的挖掘前景,但MCP-3激活对鼻咽癌发生和发展的具体调控机制仍需要研究和探讨,应成为后续工作的重点。
猜你喜欢趋化因子鼻咽癌阳性中医药治疗鼻咽癌研究进展中医眼耳鼻喉杂志(2019年2期)2019-04-13抛开“阳性之笔”:《怕飞》身体叙事评析英美文学研究论丛(2018年2期)2018-08-27MALDI-TOF MS直接鉴定血培养阳性标本中的病原菌老年医学与保健(2017年6期)2017-02-06鼻咽癌组织Raf-1的表达与鼻咽癌放疗敏感性的关系探讨癌症进展(2016年11期)2016-03-20探讨甲状腺自身抗体阳性甲亢病的131I 治疗与甲减关系中国继续医学教育(2015年1期)2016-01-06鼻咽癌的中西医结合诊治中外医疗(2015年16期)2016-01-04趋化因子及其受体在肿瘤免疫中调节作用的新进展中国医药生物技术(2015年4期)2015-12-26子宫内膜癌组织中趋化因子CXCL12及其受体CXCR4表达水平研究现代检验医学杂志(2015年4期)2015-02-06肝细胞癌患者血清趋化因子CXCR12和SA的表达及临床意义现代检验医学杂志(2015年6期)2015-02-06趋化因子与术后疼痛河南医学研究(2014年4期)2014-02-27