刘小勇 张文 杨惠林 唐天驷 罗宗平
脊柱骨折多由外伤、骨质疏松、肿瘤、感染等多种原因所致。一般认为,脊柱外伤骨折的发生率占全身骨折的5%~6%。我国是一个人口大国,随着人口老龄化,骨质疏松症也成为一个常见病,椎体脆性骨折正成为家庭与社会的负担。
椎体压缩骨折治疗历经非手术治疗与手术治疗的发展过程。非手术治疗骨折后需忍受疼痛煎熬,后期多有骨折椎体畸形。手术内固定需承受手术创伤,后路椎弓根螺钉技术多需二次手术取出内固定;
前路手术虽能重建脊柱序列和恢复脊柱高度,但手术创伤大、风险和费用高,且技术不易普及。老年患者多伴有骨质疏松,椎弓根螺钉难以可靠固定。20 世纪80年代开始的经皮椎体成形术(percutaneous vertebroplasty,PVP)[1]到90年代后期球囊的经皮椎体后凸成形术(percutaneous kyphoplasty,PKP)[2-3],通过灌注骨水泥的强化骨折椎体,临床上获得良好的止痛效果,得以广泛推广[4-7],各种杂合技术也为临床探索[8-9]。而PVP与PKP中应用的骨水泥本身不可吸收且刚度大,中断了原有的脊柱生物力学,限制了其在青壮年群体骨折的应用。
笔者运用镍钛温度记忆合金的温度记忆功能,设计了可扩张椎体支架(expandable vertrbral stent,EVS),中国发明专利号:ZL 2006 1 0024715.6,拟通过一植入骨折椎体内的支架,扩张支撑与稳定骨折椎体,较非手术治疗椎体骨折畸形愈合有支架维持骨折椎体高度和稳定骨折椎体的作用,并在扩张的空腔内选择填充材料,最终期望骨折压缩椎体在相对完好的形态中获得骨性愈合。
本文针对早期板材研制的支架[10-12]改进工艺获得管型材料研制的EVS,做定型前评估,将实验结果报告如下。
1.1 材料与设备
记忆合金管以医疗器械和外科植入物用锻造镍钛形状记忆合金标准(美国),标准号:ASTM F2063—2018。记忆合金镍含量质量比为54.5%~57.0%支架的研制:通过高能量激光切割,以外径4.5 mm,管壁厚1.0 mm的记忆合金管等分为6瓣叶,通过特殊的工艺成型与表层处理获得。
支架的尾端衔接结构(见图1、图2):①“十字槽”结构,槽深度1 mm,共5枚支架;
②内螺纹结构,螺纹深2 mm,共4枚支架。

图1 支架两种尾端衔接结构:A.图中左为内螺纹结构,右为“十字槽”结构;
B.单瓣支撑与双瓣的高度比较,“十字槽”的凹槽与瓣叶对应关系:a对应瓣叶,b对应瓣叶间

图2 A.支架“十字槽”衔接;
B.螺纹衔接
生物力学测试仪为衡翼仪器,由苏州大学骨科研究所提供。
1.2 实验方法
考虑到支架研制工艺与不同个体椎体高度差,以及支架在植入椎体后出现的瓣叶角度旋转以及应用需求,如个体或者椎体部位导致椎体高度不一致,笔者对支架测试采用两种方式:单瓣支撑(见图3)与双瓣支撑(见图4),以观察支架的生物力学曲线差异。

图3 单瓣支撑支架高度与生物力学强度测试(文中简称单瓣):A.支架的单瓣高度;
B.支架单瓣的测试状态,即单瓣抵住感应器

图4 双瓣支撑支架高度与生物力学强度测试(文中简称双瓣):A.支架的双瓣高度;
B.支架双瓣的测试状态,即双瓣抵住感应器
这两种植入方式瓣叶产生的高度差可在实际应用中根据术前椎体影像资料决定,同时减少客观上椎体大小、高度的差异需要多种规格支架带来生产工艺的问题,即以尽可能少的研制生产工艺成本,获得最广泛的实际应用。
根据椭圆的相关数学公式,支架的高度设计[12]:参照胸腰椎椎体高度,将所设计的镂空支架的中轴截面高度(a)与长度(b)比,取a/b=0.75,根据公式(1)计算支架高度。由此支架瓣叶的设计高度为16 ~18 mm(1 ~2 mm椎体不全复位),误差为±0.5 mm。本设计的支架管型时长度29 mm,顶端2 mm,尾端3 mm,中间瓣长24 mm,可确保支架植入椎体内初始长度的安全要求。
支架高度(单瓣或双瓣)=椎体原高度-[2×终板高度+x](1)
注:①椎体原高度也可以骨折椎体上下邻椎高度的均值作为参考;
②终板高度区间为2.5 ~3.5mm,2.5 mm 代表老年终板高度,3.5 mm 代表青壮年终板高度;
③x一般为1 ~2 mm,为椎体不完全复位所致。
测试参数:加载感应器感应范围10 000 N;
压缩位移设定为5 mm,位移加载速度为5 mm/min。
测试时,为了保持支架在测力底盘上的平衡,予以小纸片横穿支架,保持平衡,不影响测力结果。将测试仪微调到瓣叶接触,电脑感应器开始有力学数据读数时(不超过0.1 N),予以清零开始测试,参数设定如前。支架逐个完成测试。
本设计支架的全套辅助工具与T12椎体标本的实物对照(见图5)。

图5 EVS全套工具与T12人体脊柱标本的正侧位对比
1.3 统计学方法
采用Origin Pro 8.5 统计学软件进行统计学分析。采用假设检验配对样本t检验,P<0.05为差异有统计学意义。
所研制的9 枚支架均完成了压力测试,均无断裂,测试结束后瓣叶均复形良好。
本次支架的瓣叶为单弯设计(相对于理想状态的椭球形结构而言,椭球形结构末段力学较小[11]),支架的压力-位移曲线总体为一“厂”字形的拱形曲线(见图6-9)。
2.1 内螺纹支架的压力-位移测试
内螺纹支架的测试结果显示,无论是单瓣与双瓣支撑状态,不同支架测试的力学曲线重叠度良好,支架的工艺满意,精密度符合设计预期。在压缩位移的初始1.6 mm,单瓣与双瓣的力学曲线均随压缩位移迅速上升,在1.6 mm时均达75 N 左右(见图6、图7)。内螺纹5 mm 压力-位移终末测试值见表1。

图6 内螺纹单瓣5 mm压力—位移测试曲线

图7 内螺纹双瓣5 mm压力-位移测试曲线

表1 内螺纹5 mm压力-位移测试结果(N)
2.2 “十字槽”支架的压力-位移测试
“十字槽”支架测试结果显示,压缩从初始位移至1.6 mm处,单瓣支架的力学强度曲线略显离散,这一力量在45 ~70 N之间,推测“十字槽”的凹槽结构与瓣叶对应位置不同的影响(见图1B箭头所示);
而双瓣状态支架的测试曲线又呈现较好的重叠性,在1.6 mm压缩位移时力学强度达65 ~70 N 之间,推测尾端凹槽结构对支架尾端闭环合力产生了影响。“十字槽”支架的压力—位移测试曲线见图8、图9,其终末测试值见表2。

图8 “十字槽”单瓣5 mm压力—位移测试曲线
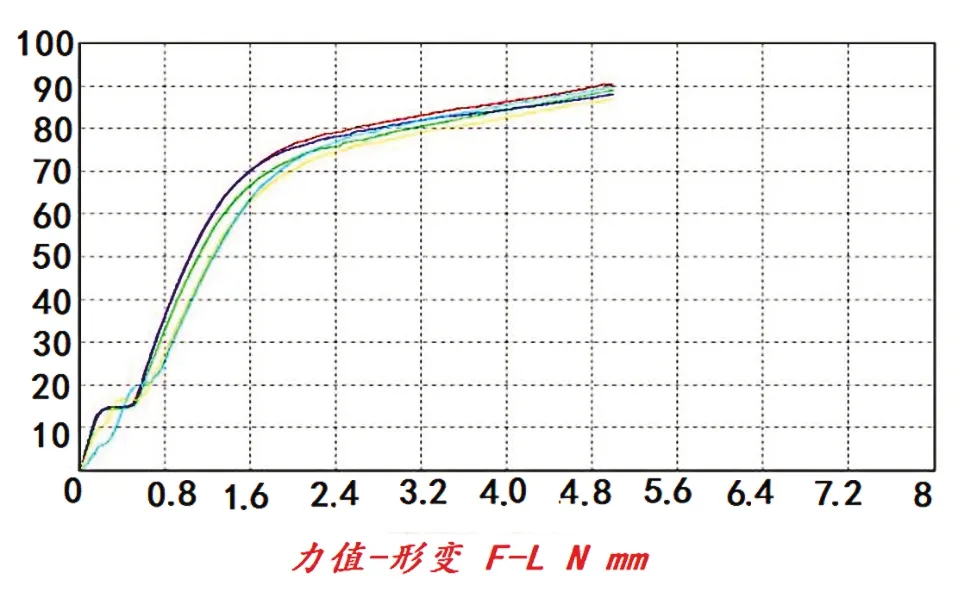
图9 “十字槽”双瓣5 mm压力—位移测试曲线

表2 “十字槽”5 mm压力-位移测试结果(N)
2.3 内螺纹与“十字槽”支架的应力比较分析
比较内螺纹的单瓣与“十字槽”的单瓣应力无明显差异,推测单瓣对称的瓣叶组成的闭环马氏体完整,在支架初始扩张阶段应力影响小;
而双瓣的应力除了支架瓣叶弧形的马氏体效应外,还受尾端闭环对两瓣叶夹角结构(见图1B箭头所示)的影响,见表3。
单瓣支撑状态内螺纹与“十字槽”结构压缩位移5 mm处两者比较,差异无统计学意义(P>0.05);
而双瓣的力学强度变化明显,差异具有统计学意义(P<0.05),见表3。

表3 内螺纹与“十字槽”支架5 mm应力—位移终末结果
支架在椎体内的实际扩张力学变化是一个递减过程。为了更直观地分析,笔者以内螺纹单瓣压力—位移曲线为例,重新编辑为直观图形(见图10)。
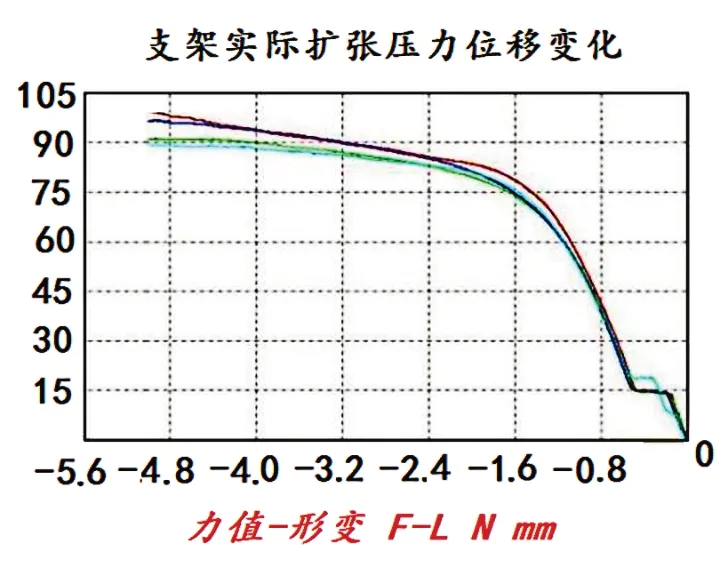
图10 内螺纹单瓣扩张应力—位移曲线
研究者们一直在探寻更好的可获得骨性愈合的新的微创治疗方法[9],目前发展到PVP与PKP的骨水泥灌注技术,期望替代骨水泥的可吸收材料技术,成为目前探索的焦点。笔者设计的记忆合金支架是期望椎体压缩骨折获得一个简化的治疗,相对于不手术治疗压缩骨折椎体获得一个相对维持椎体高度的方法:在压缩骨折椎体内植入一个有力学支撑的支架,空腔内填充可吸收成骨材料,最终获得一个骨性愈合椎体。
本设计理念上的争议主要有三点:①支架需要怎样的生物力学强度;
②支架设计的植入安全性;
③支架植入不用骨水泥胶固能否获得术后止痛效果。
3.1 支架的扩张力量与椎体内松质骨的切割和稳定
支架的力量在椎体内发挥两个作用:①实现支架对椎体内松质骨的扩张;
②获得对骨折脊柱的支撑。
支架椎体内的扩张,笔者借鉴现有球囊的临床数据:通常球囊扩张应力为100 ~200 PSI,为0.7 ~1.5 MPa(球囊的设计耐压400 PSI,即2.8 MPa)。临床上球囊的这一应力强度理论上是骨折椎体所需要的胶合力。结合正常人体松质骨的强度4 ~30 MPa。笔者认为,支架在椎体内对松质骨的扩张应力介于球囊的工作强度(1.5 MPa)与正常松质骨强度(4 ~30 MPa)之间时,即可实现对骨折椎体的扩张与支撑。
本次测试的压力—位移曲线,为支架受力压缩过程的动态反应。而支架在椎体内扩张的应力反应恰好相反(见图10),支架从工作套管内推入椎体松质骨内的瞬间,在体温作用下,支架的预扩张力最大。当支架扩张后,支架对松质骨的应力也在减小。在距支架完全扩张的末段1.6 mm直至完全扩张后支架的力量呈线性曲率降至0 N。而椎体内的骨结构越近四周骨质越致密,骨的强度也越大,支架在扩张末段对骨的应力越小,最终在椎体压力与支架扩张的抗力间获得一个微动而又相互嵌合而稳定结构。
3.2 “十字槽”支架与内螺纹支架的生物力学测试结果
支架的工艺受制于基础工业的加工能力。早期研制的支架,无相关规格的记忆合金管、受制于激光切割技术、研究经费受限等诸多因素,仅予板材研制验证其功能[10]。近年来,随着基础工业的进步和获得激光切割的成功,管型支架才得以试制成功。
作为一款植入器械,所有的操作过程都必须安全。逻辑上“十字槽”支架尾端没有降低尾管的厚度,其生物力学强度会更优;
但在植入椎体内可能因为植入椎体支架尾端与推管脱扣,无法完成可吸收骨材料的填充。而内螺纹支架则可能因为内壁螺纹工艺变薄,影响支架的整体力学强度,而且在加工精度上要求高,出现加工偏差可能导致螺纹铣刀将管壁割破或偏斜(螺纹深度0.25 ~0.3 mm,推注管壁厚0.5 mm,管外径4.0 mm;
支架外径4.5 mm,壁厚1.0 mm)。但理论上螺纹衔接后植入操作安全性能更稳定。本次初制的支架顶端2 mm,尾端3 mm,壁厚1.0 mm(抛光后0.90 ~0.95 mm),尾端如果过长带来累赘感。关键的困扰问题依旧是工艺,两种衔接设计的操作性能与生物力学强度均不能完全确定,因此测试其相关数据便于掌握结构细微变化带来的支架稳定性的变化。
本次实验证实,末段1.6 mm 的观测点,“十字槽”单瓣支架应力测试结果显示曲线有所散乱(见图8),而双瓣的生物力学强度为65 ~70 N(见图9),也小于内螺纹支架的75 N(见图6、图7),也显示“十字槽”结构与设计预期相反,推测“十字槽”客观上影响了支架尾端闭环的稳定性(因本次支架尾端长度总共3 mm,凹槽深度1.5 mm),导致生物力学强度的不稳定与降低。而内螺纹组(尾端长3 mm,螺纹深度2 mm)均呈稳定的线性曲率变化(1.6 mm 位移均为75 N,与“十字槽”结构实验前预期相反),具有较好的“末段应力”。实验证明,内螺纹结构具有稳定的生物力学强度和更安全的操作性能。这一结构上的观察为进一步的支架尾端设计提供了指导性方向(尾端取内螺纹结构,适当延长至4 mm)。
相比球囊的液压工作原理,球囊需要在最强的压力扩张状态下才能达到对骨的扩张,与支架末段压应力随着支架进一步扩张迅速减小不同(末段1.6 mm 内),球囊末段的压应力最大(OsseoFix 支架[15-18]因手动扩张,支架末段对骨的压应力也最大,而且其文献报道也需要填充PMMA)。本设计支架植入后不能扩张或仅部分扩张,说明骨的强度良好,此时支架在椎体内起到“锲子”的稳定骨折的作用。椎体内扩张后的支架与干性可吸收填充材料(见图2B)结合应用,达到了最大化的操作安全性与最佳的成骨预期。
3.3 支架的规格与单瓣或双瓣的支撑应用
支架大小规格如何适应不同椎体几何尺寸的问题,主要涉及支架的研制生产过程工艺如何简化。椎体骨折主要集中在胸腰段T11-L2这4节胸腰椎移行部位,其几何形态有相对的相似性。针对不同高度椎体的植入,可以采用支架瓣叶的旋转以单瓣支撑或双瓣支撑的方式,抵充椎体间高度差,如图3 与图4 所示,单瓣要高于双瓣近1 mm。人体26 个可活动椎体,即使每个椎体平均1 mm 高度差,可使脊柱的高度差至少达2 ~3 cm,身高差5 cm以上。而且同样尺寸的管型材料,加工曲率不同(a/b),支架的高度也不同[12],在加工工艺上也可以根据曲率调整支架高度。这样,以最少的制作工艺满足了临床最大的应用需求。因椎体骨折后,主要负重部位的椎体前柱压缩重叠1 ~2 mm,也达到恢复骨折椎体高度的90%以上[12];
过撑可导致骨折端分离,不利于骨折椎体愈合;
另一方面,椎体周缘的韧带软组织依然对脊柱有强大的牵张力,也限制了支架的过度扩张。
3.4 支架植入与止痛
骨折手术无论椎弓根螺钉技术还是PVP与PKP的骨水泥技术,均显示术后疼痛缓解。植入支架能否止痛,是支架设计中最有争议的问题。经典的疼痛反射弧理论并不能完全解释所有的疼痛机理[13],目前对疼痛机理并无统一的认识[14]。
临床上骨折后通常会感到剧烈疼痛,但闭合骨折体表感受器完好,骨折端与骨没有痛觉感受器。骨折部位获得制动后,无论是器械的内固定或者石膏夹板的外固定、或者骨水泥的胶固,骨折的疼痛随即获得缓解或消失。如粉碎性骨折术后,蝶形骨块并没有固定,但术后骨折疼痛随即消失;
脓性指头炎的减压;
晚期癌性疼痛的持续顽固等。而传统的反射弧理论似乎难以直接证明骨折后疼痛与术后即可止痛。根据这些现象的推理,笔者认为疼痛是与力学相关的机制,并且空间三维受力方向不同而产生不同的痛感。
针对骨折固定后的止痛,笔者提出“末段正向应力”的止痛假说,即骨折端满足维持其所需要最小感受平衡的力即可止痛。而本设计的支架利用记忆合金良好的弹性,对椎体骨折端起到“压缩—回弹”的应力末段维持功能。
3.5 脊柱骨折再分类
本设计支架的期望不仅限于现有PVP与PKP骨水泥的老年性压缩骨折,也期望适用于青壮年的椎体压缩骨折。为了便于本技术的应用与理解,笔者认为脊柱骨折的分类可根据骨、软组织与神经的受损情况引入新的分类:脊柱柱性骨折与局部的椎体骨折。椎体骨与软组织(椎体与椎体间韧带)和神经稳定性(椎管骨折与神经损伤)归类为柱性骨折;
以椎体骨折和周围软组织受损为主无神经侵扰的归类为椎体骨折,以便更好地指导临床应用。
本设计的支架在性能和初步实验中获得了良好的结果[10-11],本次改进的支架力学性能较早期椎体实验的支架力学性能有了质的变化。本实验结果显示,内螺纹结构的支架具有稳定的生物力学特性与操作的安全性,可作为支架设计的首选结构。
(特别致谢上海市第九人民医院戴尅戎院士在支架设计之初对记忆合金安全性的解释!)
猜你喜欢尾端内螺纹十字张竹君与中国赤十字会文史春秋(2022年4期)2022-06-16无切削加工内螺纹专利技术发展趋势的研究中国金属通报(2021年13期)2021-11-12胎儿尾端退化综合征产前超声表现1例临床超声医学杂志(2021年6期)2021-07-19十字棋数学大王·趣味逻辑(2021年3期)2021-03-10钻杆接头内螺纹加工自动化试验研究制造技术与机床(2019年8期)2019-09-03旅行牙刷发明与创新·中学生(2019年3期)2019-03-202018车企进阶十字诀汽车观察(2018年12期)2018-12-26巧用十字相乘法解题数学大世界(2018年1期)2018-04-12高强度材料内螺纹铣削刀具研究制造技术与机床(2017年11期)2017-12-18直筒飞机小学生导刊(低年级)(2016年11期)2016-11-14